Spændingsrækken | VG3
Projecter »
Related materials
Elektrode: Et stykke metal, der leder strøm til eller fra en væske kaldes en elektrode. Der findes to slags elektroder. Anoder og katoder
Anode: Den positive elektrode (der mister elektroner) kaldes en anode.
Katode: Den negative elektrode (der modtager elektroner) kaldes en katode.
Elektrolyt: Den væske man benytter til at lede strømmen i, kaldes en elektrolyt. Det skal være en væske med ioner.
Spændingsrækken er en liste over alle metallerne, hvor de er anbragt i rækkefølge efter hvor villige de er til indgå i kemiske forbindelser – fx hvor villige de er til at blive opløst i syre.
Lige som i Det periodiske system, vil metallerne til venstre reagere mere voldsomt med andre stoffer end metallerne til højre.
De metaller der er anbragt til højre, er simpelthen bedre til at holde på deres elektroner. Metallerne til venstre har mere løse elektroner, der kan fare ud og reagere med stoffer i nærheden. Derfor kalder man også metallerne til venstre for uædle, mens dem til højre kaldes ædle, de beholder i højere grad deres egenskab.
Rækken kan med formler fra Det periodiske system skrives sådan:
Cs, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, H, Cu, Hg, Ag, Au, Pt
Opløses let i syre__________________________________ Opløses ikke i syre
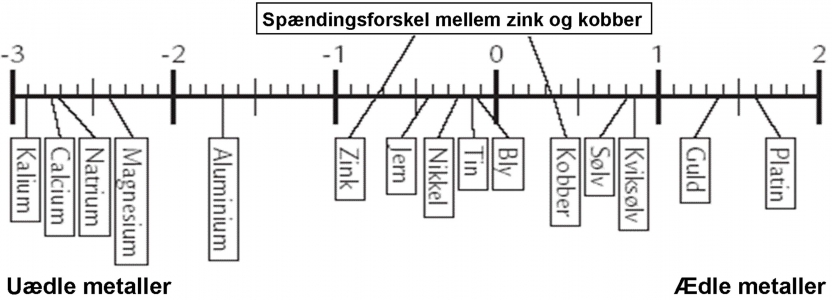
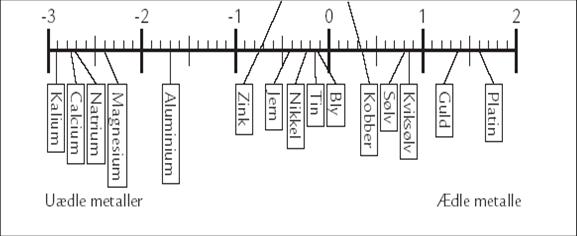
At rækken kaldes for ”spændingsrækken” skyldes, at der vil opstå en spændingsforskel mellem to forskellige metaller, når de anbringes i en væske, der kan lede strøm. Det kan aflæses på denne figur. Det er vigtigt at klikke og forstørre, så du kan aflæse spændingsforskellen mellem zink og kobber.
Saltvand kan lede strøm. Det er fordi saltvand indeholder ioner.
Anbringes to forskellige metaller i en væske med ioner, vil der vandre elektroner fra det ene metal, hen til det andet metal. Nede i væsken sker der altså en vandring af elektroner: Med andre ord: Der går en strøm. Man kan måle spændingsforskellen med et voltmeter. Jo længere de to metaller er fra hinanden i spændingsrækken, des større spændingsforskel kan man måle.
Der fjernes elektroner fra det mest reaktive metal (det der står længst til venstre i spændingsrækken). Disse elektroner vil vandre mod det andet metal, det mindre reaktive (det der står længst til højre i spændingsrækken). Man kan også kende det ved, at de metaller der står længst til venstre kan opløses i syre, derfor kalder man dem u-ædle metaller. De metaller der står længst til højre kan ikke opløses i syre, derfor kalder man dem ædle metaller.