Isotoper og kulstof 14 metoden | VG3
Projecter »
I forskellige skyer udenom kernen, kredser de negative elektroner.
Antallet af protoner i kernen fortæller os hvilket atomnummer (grundstofnummer), der er tale om.Carbon (kulstof) har fx atomnummer 6 i Det periodiske System, fordi der er 6 protoner i kernen. Det er altså grundstof nr. 6. Carbon forkortes med bogstavet C.
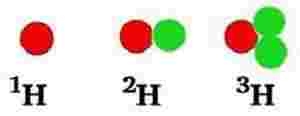
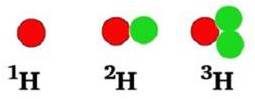
Antallet af neutroner i kernen kan variere. I 99 % tilfælde i naturen indeholder carbonatomer også 6 neutroner.
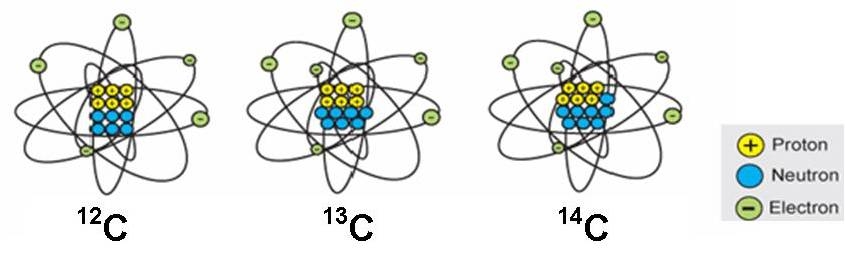
Da det i alt giver 12 kernepartikler (6 neutroner + 6 protoner), kan disse carbonatomer skrives således: 12C . Nogen skriver bare C-12.
Ønsker man samtidig at fortælle, at det er grundstofnummer 6 (altså at der er 6 protoner) så skriver man (se figur)
Måden at skrive det på, fortæller kun hvordan kernen er opbygget. Skal man vide hvordan elektronerne er fordelt, må man kigge i Det periodiske System.
I naturen er der:
12C: 99 %
13C: Næsten 1 %
14C: En millionte del
Alle er de grundstof nr. 6, men med forskelligt antal neutroner (henholdsvis 6, 7 og 8 neutroner). Ens grundstoffer med forskelligt antal neutroner er i familie. Man kalder dem isotoper. De er isotoper af samme grundstof.
Nogle isotoper er stabile og forandres dermed ikke. Andre isotoper er ustabile. Det kan skyldes, at der er et overskud af energi, eller at der er for mange neutroner. For at opnå en balance vil atomet derfor udsende partikler eller stråling. Denne aktivitet kan man måle med en geigertæller. Man siger at atomet henfalder. Store kerner (atomnumre større end 83) er altid ustabile. Alle de mindre kerner har stabile isotoper, men ofte også ustabile isotoper.
Carbon (kulstof) har to stabile isotoper. Det er 12C og 13C. Den tredje isotop, som hedder 14C er ustabil. Den findes hele tiden, som en fast del af alt levende. Hvert minut sker der ca.16 henfald i et gram carbon. Og mens stoffet er levende, erstattes det gamle 14C hele tiden med nyt 14C. På den måde er der hele tiden den samme mængde.
Men på dødt organisk materiale, bliver der ikke tilført nyt 14C. Hvis man måler aktiviteten fra 14C på en død organisme og sammenligner med en levende, så kan man udregne hvornår organismen døde. Forskere har nemlig fundet ud af, at efter 5730 år er mængden af 14C halveret. Skal man fx bestemme hvor gammel en knogle er, kan man altså måle hvor meget 14C der er tilbage i knoglen. Jo mindre, der er tilbage, jo ældre er knoglen.